全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
版主: Softfist
#1 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
https://finance.sina.com.cn/jjxw/2025-0 ... 1664.shtml
全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
《科创板日报》7月3日讯(记者 徐红) 7月3日,迪哲医药(65.050, 0.49, 0.76%)(688192.SH)宣布,公司核心产品舒沃哲®(ZEGFROVY®,通用名:舒沃替尼片)的新药上市申请正式获得美国FDA加速批准,用于经治EGFR Exon20ins突变型晚期非小细胞肺癌(NSCLC)的成人患者。
这是迪哲医药的首款出海创新药,也是全球唯一获批治疗EGFR exon20ins NSCLC口服小分子靶向疗法。
迪哲医药创始人、董事长兼首席执行官张小林博士表示:“舒沃哲®在分子设计的源头进行了重大创新,突破难治靶点,是中国首个独立研发在美获批的全球首创新药,具备疗效、安全性及便利性全球同类最佳的潜在优势。这一在美获批的里程碑事件,进一步坚定了迪哲医药致力于以突破性创新疗法填补全球未被满足临床需求的战略决心。”
迪哲医药聚焦实体瘤、血液瘤及免疫领域,公司截至目前已经建立多条产品管线,包括7款处于全球临床阶段的药物,以及多个处于临床前研究阶段的候选创新药物。
舒沃哲®在美获批之后,将如何实现商业化落地?对此,迪哲医药相关负责人回复《科创板日报》记者称,相对于国内市场,欧美市场支付能力更强,创新药定价普遍高于新兴市场,因此海外市场有望成为迪哲医药业绩增长的第二曲线。
产品定价方面,由于欧美市场与中国市场的药品支付体系有显著不同,舒沃哲®的定价将根据欧美市场的特点和规则进行定价。
此外,舒沃哲®的海外业务不排斥包括对外BD在内的任何形式的合作。“但我们不会为了BD而BD,产品的BD对产品未来的全球布局,以及对公司在这个领域的战略发展是否有利,将是我们考量的重要因素。”对方表示。
此次舒沃哲®的美国获批是基于一项国际多中心注册临床“悟空1B”(WU-KONG1B)。该项研究成果在2024年美国临床肿瘤学会(ASCO)年会以口头报告形式公布,并于近日全文发表于国际顶级杂志《临床肿瘤学期刊》(Journal of Clinical Oncology),研究结果进一步在全球范围内证明了舒沃哲®“强效缩瘤、安全可控、潜在同类最佳”。
舒沃哲®一线治疗EGFR exon20ins NSCLC的全球多中心Ⅲ期临床研究“悟空28”(WU-KONG28)目前正在美洲、欧洲、亚洲的16个国家和地区积极推进,并已于近日完成全部患者入组。随着海外临床的推进,舒沃哲®有望实现从后线到一线的跃迁,进一步释放其产品的潜力。
此前,一项于2023年欧洲内科肿瘤学会(ESMO)年会公布的汇总分析显示,舒沃哲®一线单药治疗EGFR Exon20ins NSCLC经确认的ORR达78.6%,其中300mg组中位无进展生存期(mPFS)为12.4个月。
国内市场方面,舒沃哲®和戈利昔替尼(商品名:高瑞哲®)分别在2023年8月、2024年6月获批上市,这两款产品的上市给迪哲医药带来了销售突破。
2023年,迪哲医药凭借舒沃哲®实现营收9128.86万元。进入2024年,随着高瑞哲®同时贡献销售收入,2024年全年公司营业收入3.60亿元,较上年度同比增长294%;2025年一季度,营业收入1.6亿元,同比增长达96%。公司表示,今年将全力提升医保产品的市场覆盖率,目前商业化团队已接近500人。
值得关注的是,全球针对EGFR exon20ins这一突变还有不少新药正在研发当中,如伏美替尼、PLB1004(安达替尼)等,未来市场竞争依然存在变数。
对此,迪哲医药方面向记者表示:“舒沃哲®处于该赛道的第一梯队,并且已在全球竞争中占据领先地位。凭借先发优势、FIC/BIC临床获益和全球化布局,有信心在这一领域保持领先;公司凭借分子设计的创新,已经建立技术壁垒,竞争对手需要投入大量资金,消耗较长时间才有希望追赶。”
全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
《科创板日报》7月3日讯(记者 徐红) 7月3日,迪哲医药(65.050, 0.49, 0.76%)(688192.SH)宣布,公司核心产品舒沃哲®(ZEGFROVY®,通用名:舒沃替尼片)的新药上市申请正式获得美国FDA加速批准,用于经治EGFR Exon20ins突变型晚期非小细胞肺癌(NSCLC)的成人患者。
这是迪哲医药的首款出海创新药,也是全球唯一获批治疗EGFR exon20ins NSCLC口服小分子靶向疗法。
迪哲医药创始人、董事长兼首席执行官张小林博士表示:“舒沃哲®在分子设计的源头进行了重大创新,突破难治靶点,是中国首个独立研发在美获批的全球首创新药,具备疗效、安全性及便利性全球同类最佳的潜在优势。这一在美获批的里程碑事件,进一步坚定了迪哲医药致力于以突破性创新疗法填补全球未被满足临床需求的战略决心。”
迪哲医药聚焦实体瘤、血液瘤及免疫领域,公司截至目前已经建立多条产品管线,包括7款处于全球临床阶段的药物,以及多个处于临床前研究阶段的候选创新药物。
舒沃哲®在美获批之后,将如何实现商业化落地?对此,迪哲医药相关负责人回复《科创板日报》记者称,相对于国内市场,欧美市场支付能力更强,创新药定价普遍高于新兴市场,因此海外市场有望成为迪哲医药业绩增长的第二曲线。
产品定价方面,由于欧美市场与中国市场的药品支付体系有显著不同,舒沃哲®的定价将根据欧美市场的特点和规则进行定价。
此外,舒沃哲®的海外业务不排斥包括对外BD在内的任何形式的合作。“但我们不会为了BD而BD,产品的BD对产品未来的全球布局,以及对公司在这个领域的战略发展是否有利,将是我们考量的重要因素。”对方表示。
此次舒沃哲®的美国获批是基于一项国际多中心注册临床“悟空1B”(WU-KONG1B)。该项研究成果在2024年美国临床肿瘤学会(ASCO)年会以口头报告形式公布,并于近日全文发表于国际顶级杂志《临床肿瘤学期刊》(Journal of Clinical Oncology),研究结果进一步在全球范围内证明了舒沃哲®“强效缩瘤、安全可控、潜在同类最佳”。
舒沃哲®一线治疗EGFR exon20ins NSCLC的全球多中心Ⅲ期临床研究“悟空28”(WU-KONG28)目前正在美洲、欧洲、亚洲的16个国家和地区积极推进,并已于近日完成全部患者入组。随着海外临床的推进,舒沃哲®有望实现从后线到一线的跃迁,进一步释放其产品的潜力。
此前,一项于2023年欧洲内科肿瘤学会(ESMO)年会公布的汇总分析显示,舒沃哲®一线单药治疗EGFR Exon20ins NSCLC经确认的ORR达78.6%,其中300mg组中位无进展生存期(mPFS)为12.4个月。
国内市场方面,舒沃哲®和戈利昔替尼(商品名:高瑞哲®)分别在2023年8月、2024年6月获批上市,这两款产品的上市给迪哲医药带来了销售突破。
2023年,迪哲医药凭借舒沃哲®实现营收9128.86万元。进入2024年,随着高瑞哲®同时贡献销售收入,2024年全年公司营业收入3.60亿元,较上年度同比增长294%;2025年一季度,营业收入1.6亿元,同比增长达96%。公司表示,今年将全力提升医保产品的市场覆盖率,目前商业化团队已接近500人。
值得关注的是,全球针对EGFR exon20ins这一突变还有不少新药正在研发当中,如伏美替尼、PLB1004(安达替尼)等,未来市场竞争依然存在变数。
对此,迪哲医药方面向记者表示:“舒沃哲®处于该赛道的第一梯队,并且已在全球竞争中占据领先地位。凭借先发优势、FIC/BIC临床获益和全球化布局,有信心在这一领域保持领先;公司凭借分子设计的创新,已经建立技术壁垒,竞争对手需要投入大量资金,消耗较长时间才有希望追赶。”
#2 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
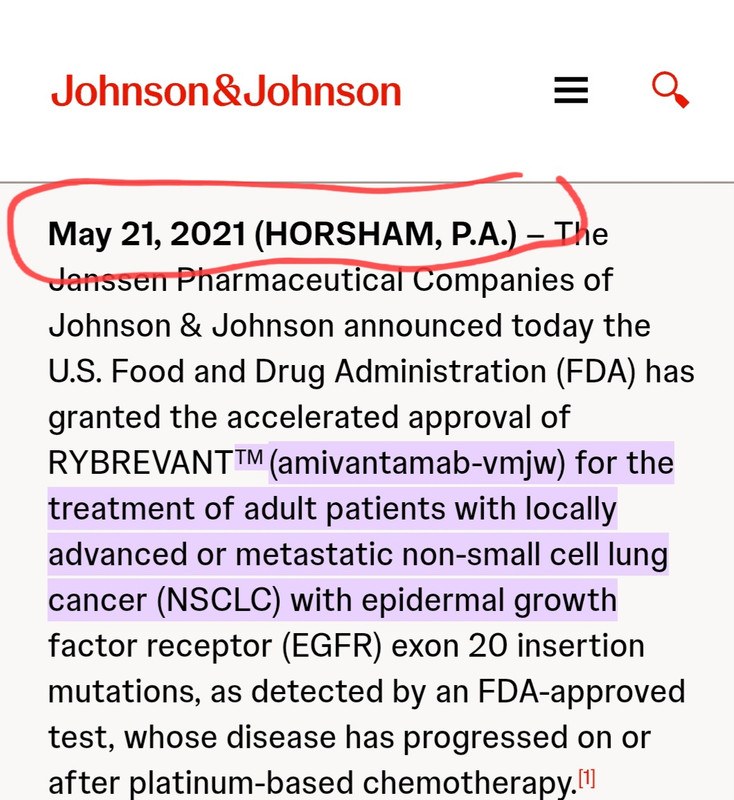
美国强生制药的Rybrevant就是治疗这个exon20ins变异的晚期NSCLC,上市好几年了,哪里来的全球首创?这个应该只是同类药口服化。本身这类变异在患者之中很少见,算是小众市场多一个选择。
国内简中新闻吹牛程度常常离谱,而且明目张胆造谣,所以特别要当心!中国原创药行业才刚刚起步,和美欧日差距很大,目前只是开发成本比较低,能够吸引国际药厂。

国内简中新闻吹牛程度常常离谱,而且明目张胆造谣,所以特别要当心!中国原创药行业才刚刚起步,和美欧日差距很大,目前只是开发成本比较低,能够吸引国际药厂。


上次由 tnc 在 2025年 7月 4日 02:45 修改。
#5 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
迪哲本來就是阿斯利康的項目,帶隊人美籍華人張小林原來就是阿斯利康的,阿斯利康內部研發新藥採用項目公司形式,快成熟了就獨立出來上市找融資,去年在上海還見過,嚴格來說這葯還是美國技術,沒啥好驚訝的
#6 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
关键强生制药早有类似产品上市,这个居然公开造谣是全球首创Noneedtohide 写了: 昨天 02:42 迪哲本來就是阿斯利康的項目,帶隊人美籍華人張小林原來就是阿斯利康的,阿斯利康內部研發新藥採用項目公司形式,快成熟了就獨立出來上市找融資,去年在上海還見過,嚴格來說這葯還是美國技術,沒啥好驚訝的
#7 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
上海上市上海公司Noneedtohide 写了: 昨天 02:42 迪哲本來就是阿斯利康的項目,帶隊人美籍華人張小林原來就是阿斯利康的,阿斯利康內部研發新藥採用項目公司形式,快成熟了就獨立出來上市找融資,去年在上海還見過,嚴格來說這葯還是美國技術,沒啥好驚訝的
#8 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
https://www.medscape.com/viewarticle/su ... 25a1000hr5
The oral EGFR inhibitor is the first small molecule approved in the US for the indication; it was previously approved in China.
The intravenous bispecific antibody amivantamab-vmjw (Rybrevant, Johnson & Johnson) also carries a second-line indication for EGFR exon 20 insertion mutated advanced/metastatic NSCLC, as well as a first-line indication with carboplatin and pemetrexed.
The oral EGFR inhibitor is the first small molecule approved in the US for the indication; it was previously approved in China.
The intravenous bispecific antibody amivantamab-vmjw (Rybrevant, Johnson & Johnson) also carries a second-line indication for EGFR exon 20 insertion mutated advanced/metastatic NSCLC, as well as a first-line indication with carboplatin and pemetrexed.
#11 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
中国魔改一切的风格终于传到药厂来了
Hard times create strong men. Strong men create good times. Good times create weak men. And, weak men create hard times.
#13 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
早在2021年就有小分子EGFR抑制物mobocertinib被FDA批准治疗有EGFR Exon 20 insertion突变的晚期肺癌了,那个才是全球第一的首创,只不过后来因为三期临床试验结果不理想,Takeda主动从市场撤回了这个药
https://www.fda.gov/drugs/resources-inf ... fr-exon-20
https://www.fda.gov/drugs/resources-inf ... fr-exon-20
#15 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
迪哲的这个药sunvozertinib现在只是被FDA加速批准,和当年的mobocertinib一样,正式批准需要看现在正在做的三期临床试验的结果。
#16 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
马来粉酱是个文盲吧,这就是mee-too, 连me-better都不算,市场上好几款targeting egfr ex20 insertion的小分子药: review都发在2019年
https://www.nature.com/articles/s41392-019-0038-9
drugs targeting EGFR Exon 20 insertion
EGFR Inhibitors Extend Their Reach in Lung Cancer | Blog | AACR
Currently, there are targeted therapies approved for treating EGFR Exon 20 insertion mutations in Non-Small Cell Lung Cancer (NSCLC).
First-line treatment options often include:
Amivantamab-vmjw (Rybrevant): A bispecific antibody targeting both EGFR and c-MET, showing efficacy in combination with chemotherapy. The combination of amivantamab and chemotherapy (carboplatin and pemetrexed) is generally used for initial treatment.
Sunvozertinib (Zegfrovy): An oral tyrosine kinase inhibitor (TKI) with broad activity against EGFR mutations, including exon 20 insertions.
上次由 TSG 在 2025年 7月 4日 09:40 修改。
#17 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
EGFR Exon 20 insertion突变在肺癌病人里占比很小,远少于exon 19 deletion和L858R突变。现在标准的一线治疗方案是EGFR/MET双抗amivantamab联合化疗,sunvozertinib被批准的适应症是二线治疗。
上次由 Blackjack21 在 2025年 7月 4日 09:45 修改。
#18 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
too哪一个?TSG 写了: 昨天 09:36 马来粉酱是个文盲吧,这就是mee-too, 连me-better都不算,市场上好几款targeting egfr ex20 insertion的小分子药: review都发在2019年
https://www.nature.com/articles/s41392-019-0038-9
#19 Re: 全球首创!迪哲医药舒沃替尼片获美国FDA加速批准上市
Sunvozertinib的确是me too药,不是首创,但它是现在市场上唯一的针对有EGFR exon 20 insertion突变的晚期肺癌的小分子药物,mobocertinib已被撤出市场,其它几个还在临床试验阶段。TSG 写了: 昨天 09:36 马来粉酱是个文盲吧,这就是mee-too, 连me-better都不算,市场上好几款targeting egfr ex20 insertion的小分子药: review都发在2019年
https://www.nature.com/articles/s41392-019-0038-9


