可我却在网上看到这个:钾钠钙镁铝,锌铁锡铅氢,铜汞银金铂
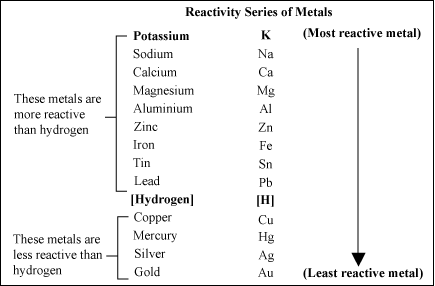

https://en.wikipedia.org/wiki/Reactivity_series
版主: huangchong


嫁给那美女,身体细纤轻。统共一百斤。YWY 写了: 2024年 6月 4日 19:59 记得中学时是这么教的:钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金
可我却在网上看到这个:钾钠钙镁铝,锌铁锡铅氢,铜汞银金铂
https://en.wikipedia.org/wiki/Reactivity_series

好吧,我不完全懂reactivity series 和 electrochemical series之间的区别,但相信你说的。Jam76 写了: 2024年 6月 4日 20:11 标准不同。
According to metal reactivity series, Na is more reactive than Ca. But according to the electrochemical series, Ca is a stronger reducing agent than Na.
YWY 写了: 2024年 6月 4日 20:49 好吧,我不完全懂reactivity series 和 electrochemical series之间的区别,但相信你说的。
记得中学背这个序列时和金属置换反应有关。

没背过这个YWY 写了: 2024年 6月 4日 19:59 记得中学时是这么教的:钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金
可我却在网上看到这个:钾钠钙镁铝,锌铁锡铅氢,铜汞银金铂
https://en.wikipedia.org/wiki/Reactivity_series
钾钡钙钠镁铝。。。YWY 写了: 2024年 6月 4日 19:59 记得中学时是这么教的:钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金
可我却在网上看到这个:钾钠钙镁铝,锌铁锡铅氢,铜汞银金铂
https://en.wikipedia.org/wiki/Reactivity_series

学习了Jam76 写了: 2024年 6月 4日 20:59 看看这个,我也不懂具体的细节
将两块大小相同的金属钠和金属钙分别投入两个盛水的烧杯里,会发现钠与水反应非常剧烈,并且钠熔成小球浮在水面,迅速游动,甚至使产生的氢气燃烧起来。钙虽能与水反应,但不及钠剧烈,并且钙沉于底部。从实验现象来看,钠比钙活泼得多。
那么,为什么不在金属活动性顺序表中把钠排在钙的前面,反而把钙排在钠的前面呢?要说明这个问题,我们必须了解金属活动性顺序是依据什么进行排列的。
其实,金属的活动性顺序并不是按金属与水反应的激烈程度来排列的,而是根据金属的标准电极电势的高低来排列的。某金属的标准电极电势的代数值越小,该金属原子变成水合离子就越容易,说明它活泼。Ca的标准电极电势是-2。76V,Na的标准电极电势是-2。
71V,故,Ca比Na容易变成水合离子,Ca比Na活泼,因此钙在顺序表中排在钠的前面,而不是排在钠的后面。金属的标准电极电势是反映金属在酸溶液中失去电子转化为水合离子过程难易程度的参数。为什么Ca的标准电极电势比Na的标准电极电势的代数值要小呢?这又要从影响金属标准电极电势大小的因素来分析。
单从能量变化的角度来看,金属的标准电极电势与金属的电离能(亦称电离势)、升华热以及水合能等因素有关。这三种能量的总和,才是金属变成水合离子的能量变化。这种能量变化的代数值越小,则相应的标准电极电势也越低,金属就越活泼。Na的升华热是109kJ/mol,电离能是496 kJ/mol,水合能是-420 kJ/mol;Ca的升华热是178 kJ/mol,电离能是590 kJ/mol,水合能是-1615 kJ/mol。
从这些数据可知,导致钙的标准电极电势比钠的标准电极电势更低或者说钙比钠的活动性要强的主要原因是钙离子的水合能比钠离子的水合能大得多。Ca2+的水合能将近是Na+的四倍,因此,水合能是衡量Ca和Na的活动性强弱的主要尺度。为什么Ca2+的水合能比Na+的水合能大呢?这与离子半径、离子所带的电荷有关。